临床研究
◎ 业务范围:
1. 临床试验
2. 医学写作
3. 数据管理
4. 生物统计
5. 第三方稽查及培训
6. CRC现场服务
◎ 业务描述:
1. 临床试验
众益维康的临床研究团队由具有多年经验的业内专家及训练有素的监查员组成,专注于I至IV期及各类上市后研究的临床研究操作,服务范围包括药品、医疗器械及体外诊断试剂和保健品,有完善的质量管理和质量控制系统,能确保项目过程符合ICH-GCP和中国GCP的要求,并能获得高质量的临床研究数据,能全面满足国际和国内客户在医药产品在临床试验方面的各类需求。
众益维康专业稳定的团队,对中国药品、医疗器械及保健品试验的要求有着深度的了解,同时依托公司专业的注册专家,能够为国内外客户提供从早期研发至最终在中国上市的多方位解决方案。丰富的临床项目管理经验、良好的医院合作关系、专业完善的培训体系,能够为客户提供符合国际标准操作流程的一流服务。
注册临床研究
目前国内临床研究市场逐步扩大,以临床研究作为核心业务的CRO纷纷成立。我们认为综合把握药品的特征,在其研发的不同时期,敏感准确地理解不同时期研究信息所彰显的科学内涵,是临床研究内在质量控制的重要依据。在此基础上,从执行层面加以细化和控制,则可以实现在体制层次上对于临床研究质量的控制,实现高质量的研究。我们致力于从临床评价科学的角度出发,整合国内顶尖临床专家,融合国际先进临床研究理念与方法,为企业提供优质的临床研究服务。
上市后研究
随着注册门槛的提高,新产品的上市周期逐渐拉长,企业依靠不断推出新产品的发展策略,在竞争程度的不断加剧的环境下,越来越难于推进企业的可持续发展。如何保护企业的核心竞争力,同时挖掘现有产品的潜力,实现市场的创新,是医药企业要面对的重要课题。我们以上市后药品再评价、药物经济学评价、药品风险管理方案研究为技术依托,创建新的知识和新的药品市场形态;以患者健康利益最大化为宗旨,实现病人利益、医生价值、药品科学性认识、企业利益实现的多方共赢;以上市后科学研究为支撑,整合国内顶尖的专家资源与科研资源,实现产品市场深度和广度的创新型拓展。
服务内容:
1)研究中心及主要研究者的选择
2)研究者会议组织
3)伦理委员会的申报批准
4)研究中心协议的商定
5)研究中心的启动
6)临床试验的监查与管理
7)临床试验稽查和质量控制
8)研究中心的关闭
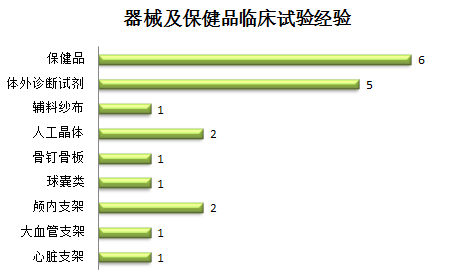
项目经验: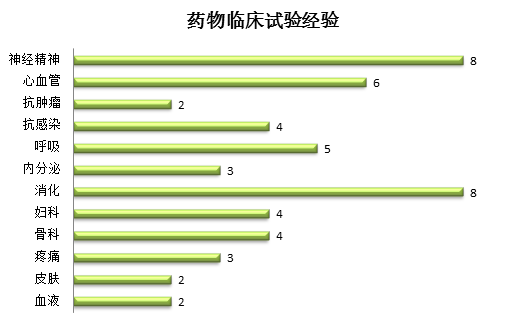
2. 医学写作
医学写作贯穿于临床试验的全过程,医学支持团队的重要性毋庸置疑。众益维康的医学支持团队采用公司统一的SOPs和文件模版,凭借在临床研究多个领域丰富的实践经验,确保提供始终如一的高标准服务。
服务内容:
1)临床试验的设计和方案撰写
2)临床试验报告的撰写
3)临床试验可行性研分及咨询
4)药物安全性监测
5)医学信息服务
6)医学翻译
3. 数据管理
根据客户的需求,可根据所使用的纸质CRF或EDC系统的具体情况实施数据管理工作,并与多家E-CRF或EDC系统的供应商进行合作,最大限度地保证临床试验数据的严谨性和可靠性。
服务内容:
1)CRF设计与注释
2)数据管理计划和数据核查计划制定
3)数据库建立和验证
4)数据逻辑核查程序编写与测试
5)数据双份输入和质疑对比
6)EDC设计与实施、培训及技术支持
7)临床数据审核
8)中心实验室数据处理和上传
9)发质疑表、解决质疑
10) 医学编码
11) 严重不良事件(SAE) 核查
12) 数据管理稽查与质量控制
13) 盲态核查、数据库锁定
14) 数据移交
15) 数据文件存档的管理
4. 生物统计
与多位国内著名的生物统计学家合作,在生物统计方面具有丰富的实践经验和良好的口碑。作为临床研究的重要组成部分,统计人员将从方案设计开始,全程参与临床项目的管理,确保服务的准确、及时与高效,满足客户的需求。
服务内容:
1)提供方案设计的统计意见
2)样本量估算
3)设盲和编盲
4)统计分析计划撰写
5)中期分析
6)统计分析报告撰写
7)上市后调查研究数据分析
5. 第三方稽查及培训
众益维康的稽查团队可根据客户的需求,根据具体项目情况提供第三方稽查服务,并可安排经验丰富的临床研究专家应客户需求定制并实施培训计划。
服务内容:
1)临床试验管理计划和管理工具设计
2)临床试验SOP撰写
3)临床试验独立第三方稽查
4)临床试验相关培训
6. CRC现场服务
北京斯闻瑞恩国际医药科技有限公司是众益维康下属的SMO公司,拥有者一支四十多人的专业CRC团队,分布在中国的各个省会及省会周边城市。凭借完善的培训和质控体系,以及适合中国本土特色的多种合作模式,将为您提供专业的CRC现场服务。
服务内容:
1)研究中心启动准备
2)伦理文件的准备、递交及跟踪
3)研究中心文档整理
4)受试者招募
5)受试者访视管理
6)实验室流程跟踪
7)原始文件收集整理
8)病例报告表填写
9)研究药物及物资管理
10)配合监查工作
11)中心关闭相关工作

